PUNTO DE PARTIDA
1.
¿Los avances y las
sustancias químicas pueden desequilibrar el ecosistema?
2.
1. ¿Cuáles son los
ciclos que ayudan a depositar los residuos orgánicos?
2.2 Enumera las sustancias químicas que son
vertidas al mar.
Qué es la cadena alimenticia
La
cadena alimenticia, también conocida como cadena trófica, es el
proceso por el cual se transfiere energía alimenticia por medio de seres vivos, en donde cada uno de estos se alimenta del anterior y es alimento del siguiente. La cadena alimenticia es además
una corriente de nutrientes y energía establecida entre las distintas especies de un ecosistema en relación a la nutrición del mismo.
Cada cadena alimenticia
tiene su inicio en un vegetal o en un organismo autótrofo, es decir que es capaz de fabricar su propio alimento ya sea sintetizando sustancias orgánicas, usando
energía solar o mediante el uso de sustancia y reacciones químicas.
El resto de los integrantes de la cadena alimenticia son denominados como los consumidores. El consumidor primario es quien se alimenta del organismo autótrofo, es decir, del productor. Quien se alimente del primario será el consumidor secundario que generalmente es carnívoro, mientras el tercero sería un ovnivoro o un supercarnívoro. Obviamente el consumidor primario será un herbívoro mientras el cuarto será un necrofago.
La cadena alimenticia cuenta con un último nivel donde ubicamos a descomponedores y degradadores, quienes actúan sobre organismos muertos, descomponiendo la materia orgánica y transformándola de nuevo en inorgánica para devolverla al
suelo y a la
atmósfera, y así, dar inicio otra vez a la cadena.
La cadena alimenticia cuenta con ciertos “eslabones”, los cuales obtienen la energía necesaria para la vida gracias al eslabón anterior, mientras el productor la obtiene del sol o por otro medio. De esta forma, la energía fluirá de forma lineal a través de la cadena alimenticia, pero se producen pérdidas de energía cuando se pasa de un eslabón a otro, por lo tanto uno de los últimos eslabones recibirá menor energía que uno de los primeros. Debido a esto último, la longitud de la cadena va aproximadamente hasta el cuarto o tercer consumidor. Algunos ejemplos de cadena alimenticia son los siguientes:
-Alfalfa -> Conejo -> Serpiente -> Halcón/Águila.
Algunas veces, en la cadena alimenticia se da la desaparición de un eslabón, lo cual es una completa desventaja ya que:
1-Con él, desaparecerán el resto de los elabones siguientes ya que no tendrán alimento.
2-El nivel anterior quedará superpoblado
3-Como consecuencia de los dos puntos anteriores, los niveles más bajos quedarán en desequilibrio.
Este suceso ocurre en raras ocasiones ya que la cadena alimenticia en sentido estricto no existe. Cuando desaparezca un eslabón, aparecerá otro consumidor, por lo tanto el ecosistema rara vez variará, pero de todas formas se debe mantener la mano del hombre alejada del tema ya que si queremos lograr una mejor
ecología es mejor
permitir que la cadena alimenticia siga con sus procesos.
Sustancias Reguladas
El Convenio determina a una docena de compuestos sobre los que es preciso emprender acciones de forma prioritaria, conocida como la "docena sucia", debido a sus efectos dañinos, su presencia en el medioambiente y su persistencia en el interior del cuerpo humano dado que son productos organoclorados.
3 Figuran en tres categorías. (Dos productos químicos, hexaclorobenceno y bifenilos policlorados, se muestran tanto en las categorías A y C.)
| Anexo | Nombre | Número CAS | Excepciones |
|---|
| A. Eliminación | Aldrina | 309-00-2 | Producción: Ninguna.
Uso: Insecticida y ectoparasiticida locales. |
| A. Eliminación | Bifenilos policlorados (PCBs) | Varios | Producción: Ninguna. Uso: de acuerdo con la parte II del anexo A del Tratado. |
| A. Eliminación | Clordina | 57-74-9 | Producción: Partidos inscritos.
Uso: Ectoparasiticida local, insecticida, termiticida (incluso en los edificios, represas y caminos) y como aditivo para adhesivos de contrachapado. |
| A. Eliminación | Dieldrín | 60-57-1 | Producción: Ninguna.
Uso: Operaciones agrícolas. |
| A. Eliminación | Endrina (plaguicida) | 72-20-8 | Ninguna. |
| A. Eliminación | Heptacloro | 76-44-8 | Producción: Ninguna
Uso: Termiticida (incluyendo en la estructura de las casas y metro), para el tratamiento orgánico y en cajas de cableado subterráneo. |
| A. Eliminación | Hexaclorobenceno | 118-74-1 | Producción: Partidos inscritos.
Uso: Solvente para insecticidas. |
| A. Eliminación | Mirex | 2385-85-5 | Producción: Partidos inscritos.
Uso: Termiticida. |
| A. Eliminación | Toxafeno | 8001-35-2 | Ninguna. |
| B. Prohibición | Dicloro Difenil Tricloroetano (DDT) | 50-29-3 | |
| C. Producción inintencionada | Bifenilos policlorados (PCBs) | Varios | |
| C. Producción inintencionada | Dioxina y los Dibenzofuranos policlorados | Varios | |
| C. Producción inintencionada | Hexaclorobenceno | 118-74-1 | |
Creado por la Cuarta Conferencia de las Partes, mayo de 2009
Efectos de la contaminación en la naturaleza
En el hombre

Efectos sobre la salud de algunos de los más típicos contaminantes.
75 76 77
La contaminación del agua causa aproximadamente 14 000 muertes por día, la mayoría debido a la contaminación de
agua potable por
aguas negras no tratadas en
países en vías de desarrollo. Un estimado de 700 millones de
hindúes no tienen acceso a un sanitario adecuado, 1 000 niños hindúes mueren de enfermedades diarreicas todos los días.
78 Alrededor de 500 millones de chinos carecen de acceso al agua potable.
79 656 000 personas mueren prematuramente cada año en
China por la contaminación del aire. En
India, la contaminación del aire se cree causa 527 700 muertes cada año.
80 Estudios han estimado en cerca de 50 000 muertes en Estados Unidos por contaminación del aire.
81
Se ha probado recientemente que la contaminación puede reducir la
fertilidad tanto en hombres como mujeres. En hombres reduce la calidad del
semen y puede producir esterilidad. En la mujeres menores a 40 años pude provocar una
menopausia precoz debido a una reducción radical de su reserva
ovárica.
82
Clasificación según los grupos funcionales[editar]
Los compuestos orgánicos también pueden contener otros elementos, también otros grupos de átomos además del carbono e hidrógeno, llamados
grupos funcionales. Un ejemplo es el grupo hidroxilo, que forma los
alcoholes: un átomo de oxígeno enlazado a uno de hidrógeno (-OH), al que le queda una valencia libre. Asimismo también existen funciones
alqueno (dobles enlaces),
éteres,
ésteres,
aldehídos,
cetonas,
carboxílicos, carbamoilos,
azo,
nitro o
sulfóxido, entre otros.
Oxigenado
Son cadenas de carbonos con uno o varios átomos de oxígeno. Pueden ser:
- Alcoholes: Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
- Aldehídos: Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al:
Es decir, el grupo carbonilo H-C=O está unido a un solo radical orgánico.

2-Butanona o metil-etil-cetona
- Cetonas: Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.1 Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno. El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.
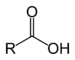
- Ácidos carboxílicos: Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H...
- Ésteres: Los ésteres presentan el grupo éster (-O-CO-) en su estructura. Algunos ejemplos de sustancias con este grupo incluyen el ácido acetil salicílico, componente de la aspirina, o algunos compuestos aromáticos como el acetato de isoamilo, con característico olor a plátano. Los aceites también son ésteres de ácidos grasos con glicerol.
- Éteres: Los éteres presentan el grupo éter(-O-) en su estructura. Suelen tener bajo punto de ebullición y son fácilmente descomponibles. Por ambos motivos, los éteres de baja masa molecular suelen ser peligrosos ya que sus vapores pueden ser explosivos.
Nitrogenados
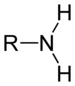
- Aminas: Las aminas son compuestos orgánicos caracterizados por la presencia del grupo amina (-N<). Las aminas pueden ser primarias (R-NH2), secundarias (R-NH-R") o terciarias (R-NR´-R"). Las aminas suelen dar compuestos ligeramente amarillentos y con olores que recuerdan a pescado u orina.
- Amidas: Las amidas son compuestos orgánicos caracterizados por la presencia del grupo amida (-NH-CO-) en su estructura. Las proteínas o polipéptidos son poliamidasnaturales formadas por enlaces peptídicos entre distintos aminoácidos.
- Isocianatos: Los isocianatos tienen el grupo isocianato (-N=C=O). Este grupo es muy electrófilo, reaccionando fácilmente con el agua para descomponerse mediante latransposición de Hofmann dar una amina y anhídrico carbónico, con los hidroxilos para dar uretanos, y con las aminas primarias o secundarias para dar ureas.
Cíclicos
Aromático
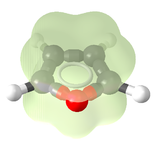
El
Furano (C
4H
4O) es un ejemplo de compuesto aromático. Estructura tridimensional del Furano mostrando la nube electrónica de electrones
π.
Los compuestos aromáticos tienen estructuras cíclicas insaturadas. El
benceno es el claro ejemplo de un compuesto aromático, entre cuyos derivados están el
tolueno, el
fenol o el
ácido benzoico. En general se define un compuesto aromático aquel que tiene anillos que cumplen la
regla de Hückel, es decir que tienen 4
n+2 electrones en orbitales π (n=0,1,2,...). A los compuestos orgánicos que tienen otro grupo distinto al carbono en sus cilos (normalmente N, O u S) se denominan
compuestos aromáticos heterocíclicos. Así los compuestos aromáticos se suelen dividir en:
- Derivados del benceno: Policíclicos (antraceno, naftaleno, fenantreno, etc), fenoles, aminas aromáticas, fulerenos, etc
- Compuestos heterocíclicos: Piridina, furano, tiofeno, pirrol, porfirina, etc
Isómeros
Ya que el carbono puede enlazarse de diferentes maneras, una cadena puede tener diferentes configuraciones de enlace dando lugar a los llamados
isómeros, moléculas tienen la misma fórmula química pero distintas estructuras y propiedades.
Existen distintos tipos de
isomería: isomería de cadena, isomería de función, tautomería, estereoisomería, y estereoisomería configuracional.
El ejemplo mostrado a la izquierda es un caso de isometría de cadena en la que el compuesto con fórmula C
6H
12 puede ser un ciclo (
ciclohexano) o un alqueno lineal, el
1-hexeno. Un ejemplo de isomería de función sería el caso del
propanal y la
acetona, ambos con fórmula C
3H
6O.
Compuestos orgánicos
Los compuestos orgánicos pueden dividirse de manera muy general en:
HIDROCARBUROS POR :
Trabajo
sobre los hidrocarburos por:

.jpg)





.jpg)
.jpg)
.jpg)